|
第三章 金属及其化合物
(时间90分钟,满分100分)
一、选择题(本题包括16个小题,每小题3分,共48分)
1.如图标出了各种材料强度与密度的比值以及广泛使用的年代.从图中可以看出的信息有 ( )
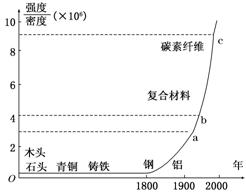
A.科学技术的发展越来越快,新材料频频出现
B.新材料发展的总体趋势是强度越来越大
C.1800年以前出现的材料强度都比铝小
D.铝的密度比钢的密度大
解析:B项、C项都是单独分析材料的强度或密度,而图中提供的是强度和密度之比同出现时间的关系,与题意不符.D项中钢的密度比铝的密度大.
答案:A
2.NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子
B.1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA个
C.各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
D.2.7 g铝与足量的NaOH溶液反应,转移的电子总数为NA
解析:B项,Al在冷的浓HNO3中钝化,Al未完全反应;C项,Fe+2HCl===FeCl2+H2↑,2Fe+3Cl22FeCl3,所以5.6 g Fe与盐酸反应转移0.2NA个电子,而与Cl2反应则转移0.3NA个电子;D项,发生反应2Al+2NaOH+2H2O===2NaAlO2+3H2↑,2.7 g Al转移电子0.3NA个.
答案:A
3.将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为 ( )
A.3∶2 B.2∶1
C.3∶4 D.4∶3
解析:设每份铁铝合金样品中含铁、铝的物质的量分别为x、y,则由FeH2↑、Al H2↑、Al H2↑三个关系式得知(x+)∶y=3∶2,解得x∶y=3∶4.
答案:C
4.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu===2FeCl2+CuCl2.向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 ( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
解析:铁的还原性比铜强,FeCl3首先氧化Fe;只有Fe反应完后,剩余的FeCl3才能再氧化Cu.故烧杯中有铁无铜是不可能的.
答案:B
5.200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均式量为 ( )
A.5.8 B.11.6
C.23.2 D.46.4
解析:(1)估算法:因原混合气体为CO2和H2O,故其平均式量应介于44和18之间,故应为选项C.
(2)差量法:
参与反应的气体的物质的量应为O2的2倍,n(O2)==0.25 mol,n(混气)=2×0.25 mol=0.5 mol,=11.6 g/0.5 mol=23.2 g/mol
即平均相对分子质量为23.2.
答案:C |

