《现代教育报·新课程周刊》原创精品样稿
高考化学选择题满分策略
广东南海石门中学 王怀文
考情快递
高考化学的选择题是同学们夺分的利器,相比第II卷来说,选择题较易得分。2007年广东高考化学的选择题总分为70分,考生平均得分达55分左右,说明考生在平时十分重视选择题的训练。如果在保证正确率的前提下,掌握好选择题的题型及解题技巧,相信会为第II卷的答题争取更多的时间,因此考生对高考常见的选择题解题方法进行归纳十分有必要。
1.选择题考查内容
高考化学选择题重点考查基本概念和基本理论,约70%,此外实验题、有机题、元素化合物各2道左右,计算题考查要求近年有所降低,1题左右。
2.选择题应对策略
理解、掌握好基本知识、掌握基本解题技能是解好选择题的关键。基本概念和基本理论题讲究知识理解是否到位,实验知识重点要掌握基本操作,元素化合物、有机化学一般是考查相关物质的性质,计算题则淡化计算技巧,讲究计算的基本方法和原理。
高手过招
解题的关键主要是掌握相关知识的内在规律,不用花太多心思去找什么窍门。高考的时间有限,不可能考什么偏、难、怪的题目,考生只须掌握常见方法则可。选择题的选择方法因题而异,不同的类型有不同的原则,常用的方法主要有以下几种。
高招1 直接法
此类题主要考某个或某些知识点的掌握情况,考得直接,利用基本概念、原理或物质的性质就可以解题,是最常出现的考题情况。
例1 (2007年上海高考卷)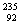 U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会关注。下列有关 U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会关注。下列有关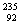 U说法正确的是 U说法正确的是
A.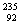 U原子核中含有92个中子 B. U原子核中含有92个中子 B.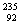 U原子核外有143个电子 U原子核外有143个电子
C.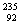 U与 U与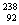 U互为同位素 D. U互为同位素 D.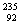 23592U与 23592U与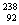 U互为同素异形体 U互为同素异形体
解析: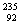 U原子核中有92个质子、143个中子,核外有92个电子, U原子核中有92个质子、143个中子,核外有92个电子,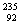 U与 U与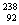 U互为同位素。 U互为同位素。
答案:B
高招2 筛选法
对于单项选择题,考生在对题目所要求的知识与掌握掌握不全面时,要学会抓住关键信息大胆假设,小心排除,筛选最佳选项。
例2 水的状态除了气、液和固态外,还有玻璃态,它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状、不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是(单
A.水由液态变玻璃态,体积缩小 B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态 D.玻璃态水是分子晶体
解析:此题情景很新,一般我们也很难观察到这种水,抓题目所给的信息来思考:玻璃态的水密度与普通液态水的密度相同,质量不变,那么两种状态的水体积应是相同的。题目中说玻璃态的水无固定形状,不存在晶体结构,由此可见C应是正确的。
答案:C
高招3 代入法
当题目的发散性比较强而求解困难时,可将选项代入或用个别可能情况尝试。
例3 已知IA族的短周期元素A和VIA族短周期元素B,二者能形成的化合物化学式为
A.AB型 B.A2B型 C.AB2型 D.A2B2型
解析:以钠与氧为例可以写出Na2O 、Na2O2 两种化合物。
答案:BD
高招4 归一法
实质是化抽象为具体。使问题明朗化。因此,利用此思路使选择过程简单,从而化难为易。
例4 某一盛满硫酸溶液(密度为1.4克/厘米3)的试管,其质量是47克,若用这一试管盛满硝酸溶液(密度为1.2克/厘米3)其质量为42克,则该试管最多能盛水
A.35ml B.10ml C.25ml D.20ml
解析:用相同的试管盛两种溶液,则试管的质量、体积保持不变。恰恰这两个不变值均未知。常规解法应通过设两个未知数,借助密度关系建立方程求解。现采用归一法:设试管体积有1毫升,则溶液质量差为(1.4-1.2克),现设试管为V毫升,溶液质量差为(47-42)克。故有1∶(1.4-1.2)=V∶(47-42).V=25,这样就可快速得出答案。
答案 :C
一般本科题
1.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是 ( )
A.研制水溶剂涂料替代有机溶剂涂料
B.用可降解塑料生产包装盒或快餐盒
C.用反应:Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O 制备硫酸铜
 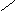
 D.用反应:2CH2=CH2+O2 2CH2—CH2制备环氧乙烷 D.用反应:2CH2=CH2+O2 2CH2—CH2制备环氧乙烷
2.生产、生活离不开各种化学物质,下列说法不正确的是 ( )
A.不需要通过化学反应就能从海水中获得食盐和淡水
B.潜水艇在紧急情况下可用过氧化钠供氧
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.工业上常用硅制造光导纤维
3.微观粒子是化学研究的主要对象。若阿伏加德罗常数为6.02×1023mol—1,下列对粒子数判断正确的是 ( )
A.常温常压下,2.24L CO2气体中含有的分子数为0.1×6.02×1023
  B.2.8g [CH2—CH2 ]n 中含有的碳原子数为0.2×6.02×1023 B.2.8g [CH2—CH2 ]n 中含有的碳原子数为0.2×6.02×1023
C.0.3L 1mol/L Na2SO4 溶液中含有的Na+数为0.3×6.02×1023
D.1.7gNH3中含有的质子数为0.4×6.02×1023
4.若向100mL的FeBr2溶液中通入标准状况下的Cl23.36L,测得形成的溶液中Cl-离子和Br-离子的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为
A 0.75mol/L B 1.5mol/L C 2mol/L D 0.3mol/L
5.氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是 ( )
A.电解熔融氯化钠制取金属钠的反应中,钠离子被还原,氯离子被氧化
B.湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C.用磁铁矿炼铁的反应中,1mol Fe3O4被CO还原成Fe,转移9mole—
D.铝热法还原铁的反应中,放出的热量能使铁熔化
6.下列离子方程式正确的是 ( )
A.二氧化硅与氢氧化钠溶液反应:SiO2+2OH— SiO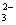 +H2O +H2O
B.碳酸钙与盐酸反应:CO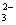 +2H+ +2H+ CO2↑+H2O
C.硫酸与氢氧化钡溶液反应:Ba2++OH—+H++SO BaSO4↓+H2O
D.铝与氢氧化钠溶液反应:Al +2OH— AlO +H2↑ +H2↑
7.下列叙述不正确的是 ( )
A.可用装置①鉴别碳酸钠和碳酸氢钠 B.可用装置②证明氨气极易溶于水
C.可用装置③从海水中得到淡水 D.可用装置④把胶体从溶液中分离出来
8.下列关于实验中颜色变化的叙述正确的是 ( )
A.将二氧化硫通入品红溶液中,溶液显红色,加热后变为无色
B.向葡萄糖溶液中加入新制的氢氧化铜,加热至沸,静置后上层溶液显红色
C.将湿润的红纸条放进盛有氯气的集气瓶中,红纸条褪色
D.用标准氢氧化钠溶液滴定含酚酞指示剂的盐酸,终点时溶液由红色变为无色
重点本科题
9.下列各组中的X和Y两种原子,化学性质一定相似的是 ( )
A.X原子和Y原子最外层都只有一个电子
B.X原子的核外电子排布为1s2,Y原子的核外电子排布为1s22s2
C.X原子2p能级上有三个电子,Y原子的3p能级上有三个电子
D.X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电
10.下列说法正确的是 ( )
A.第二周期元素的第一电离能随原子序数递增依次增大
B.卤族元素中氟的电负性最大
C.CO2、SO2都是直线型的非极性分子
D.CH2=CH2分子中共有四个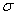 键和一个 键和一个 键 键
11.下列叙述正确的是 &nb, sp; ( )
A.原子晶体中可能存在极性共价键 B.干冰升华时分子内共价键发生断裂
C.原子晶体的熔点比分子晶体的熔点高 D.离子晶体中只含离子键,不含共价键
12.已知热化学方程式:
C(金刚石,s)+O2(g)=CO2(g) △H1
C(石墨,s)+O2(g)=CO2(g) △H2
C(石墨,s) C(金刚石,s) △H3=1.9kJ/mol
下列说法正确的是 ( )
A.石墨转化成金钢石的反应是吸热反应
B.金刚石比石墨稳定
C.△H3=△H1 -△H2
D.△H1>△H2
13.铅蓄电池在现代生活中有广泛的应用。其电极材料是Pb和PbO2,电解质是硫酸。下列说法正确的是 ( )
A.电池放电时,每消耗0.1molPb,共生成0.1mol PbSO4
B.电池放电时,电池负极周围溶液c(H+)不断增大
C.电池充电时,阴极反应为:Pb-2e—+SO PbSO4
D.电池充电时,电池正极和电源的正极相连接
14.下列判断正确的是 ( )
A.酸性溶液中Fe3+、Al3+、NO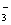 能大量共存 能大量共存
B.AlCl3溶液蒸干后得到的固体是AlCl3
C.在0.1mol/L CH3COONa溶液中,c(OH—)=c(CH3COOH)+c(H+)
D.pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合后,溶液pH=7
15.下列说法不正确的是 ( )
A.2—丁烯不存在顺反异构体
B.乙醛的核磁共振氢谱中有二个峰,峰面积之比是1:3
C.乙醇的沸点远高于丙烷,是由于乙醇分子间存在氢键
D.氨基酸与酸、碱都能发生反应生成盐
参考答案
一般本科题
1.C 2.D 3.B 4. C 5.C 6.A 7.D 8.C
重点本科题
9.C 10.B 11.AC 12.A 13.D 14.AC 15.A
|

