|
石齐学校2011届毕业班第一次月考化学试卷
可能用到的相对原子质量:
H-1 C-12 O-16 Na-23 Al-27 S-32 Cl-35.5 Fe-56 Cu-64 Ag-108 Ba-137
一.选择题:每小题只有一个选项符合题意(每小题3分、共48分)
1.下列过程中,最终的白色沉淀不一定是BaSO4的是
A.Fe(NO3)2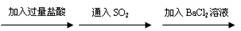 白色沉淀 白色沉淀
B.Ba(NO3)2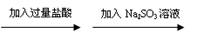 白色沉淀 白色沉淀
C.某无色溶液 无沉淀 无沉淀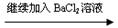 白色沉淀 白色沉淀
D.某无色溶液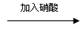 无色溶液 无色溶液 白色沉淀 白色沉淀
2.根据下列实验内容得出的结论正确的是
|
选项 |
实 验 内 容 |
结 论 |
|
A |
某物质的水溶液使红色石蕊试纸变蓝 |
该物质一定是碱 |
|
B |
某气体能使湿润淀粉碘化钾试纸变蓝 |
该气体一定是氯气 |
|
C |
某物质的水溶液中加入盐酸产生无色无味气体 |
该溶液一定含有碳酸根离子 |
|
D |
往铁和稀硝酸反应后的溶液中滴入KSCN溶液,溶液显血红色 |
反应后溶液中肯定有Fe3+,可能还有Fe2+ |
3.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
|
序号 |
被提纯的物质 |
除杂试剂 |
分离方法 |
|
① |
氯化钠溶液(碘化钠) |
氯水、四氯化碳 |
萃取、分液 |
|
② |
氯化铵溶液(氯化铁) |
氢氧化钠溶液 |
调节PH=4,过滤 |
|
③ |
二氧化碳(一氧化碳) |
氧化铜粉末 |
加热 |
|
④ |
苯(苯酚) |
氢氧化钠溶液 |
过滤 |
A.①②③④ B.②③ C.①③ D.③④
4.下列离子方程式正确的是
A.用惰性电极电解硫酸铜溶液: Cu2+ +2OH-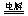 Cu↓ + H2↑+O2↑ Cu↓ + H2↑+O2↑
B.浓烧碱溶液中加入铝片:Al+2OH-=AlO2-+H2↑
C.在水中加人少量的过氧化钠粉末 2O22- + 2H2O=4OH- + O2↑
D.Ba(OH)2溶液中滴入NaHSO4溶液至恰好为中性:
2H+ +SO42- + Ba2+ +2OH-=BaSO4↓+2H2O
5. X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.由于氢键的影响,3种元素的气态氢化物中X的气态氢化物最稳定
D.原子半径由小到大的顺序为Z<Y<X
6.下列各组物质中,气体X和气体Y在通常条件下同时通入盛有溶液z的洗气瓶中(如右下图所示),一定没有沉淀生成的是
|
|
X |
Y |
Z |
|
A |
NO2 |
SO2 |
BaCl2 |
|
B |
NH3 |
O2 |
Al2(SO4)3 |
|
C |
NH3 |
CO2 |
NaCl(饱和) |
|
D |
CO |
O2 |
Ca(OH)2 |
7.下列涉及有机化合物的说法正确的是
A.乙醇可以转化成乙酸,乙醇和乙酸都能发生取代反应
B.所有烷烃和蛋白质分子中都存在碳碳单键
C.2-氯丁烷与NaOH乙醇溶液共热所得有机产物只有一种
D.甲基、羟基、羧基三种基团两两结合形成的有机物有3种
8.用NA表示阿伏伽德罗常数的值。下列叙述正确的是
A.100mL 1mol/L Al2(SO4)3溶液中,阳离子总数少于0.2NA
B.常温常压下,18.0 g重水(D2O)所含的电子数为NA
C.8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA
D.在标准状况下,22.4L NO与11.2L O2混合后所得的气体含分子数为NA
9.关于浓度均为0.1 mol/L的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法不正确的是
A.c(CH3COO-):③>①
B.①和③等体积混合后的溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH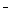 ) )
C.①和②等体积混合后的溶液: c(OH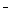 )=c(H+)+ c(CH3COOH) )=c(H+)+ c(CH3COOH)
 D.水电离出的c(OH-):②<① D.水电离出的c(OH-):②<①
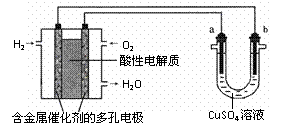
10.根据右图回答,下列说法不正确的是
A.此装置用于铁表面镀铜时,a为铁
B.若a、b为Pt电极,b的电极反应
式为:Cu2++2e-=Cu
C.燃料电池中正极反应为O2 + 4e- +4H+=2H2O
D.若a为粗铜,b为纯铜,该装置可用于铜的精炼
11.下列物质肯定为纯净物的是
A.只有一种元素组成的物质 B.只有一种分子构成的物质
C.只有一种原子构成的物质 D.明矾或氢氧化铝胶体
12.N2O5是一种新型硝化剂,某温度下有反应:2N2O5(g) 4NO2(g)+O2(g) △H>0,下表为T1温度下的部分实验数据:
|
|
0 |
500 |
1000 |
1500 |
|
C(N2O5)mol/L |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法不正确的是
A.Tl温度下的平衡常数为Kl=125
B.500s内N2O5分解速率为2.96×10-3mol/(L·s)
C.其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3.则T1>T3 |

