|
习题精练
1.下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是( )
A.使用催化剂,使氮气和氢气的混合气体有利于合成氨
B.高压比常压条件更有利于合成氨的反应
C.500 ℃左右比室温更有利于合成氨的反应
D.合成氨时采用循环操作,可提高原料的利用率
解析:使用催化剂能同等程度地加快v(正)、v(逆),而平衡不发生移动,A项不合题意;合成氨的反应是气体体积缩小的反应,增大压强,平衡向正反应方向移动,B项符合题意;合成氨的反应是吸热反应,则低温才有利于平衡正向移动,实际生产中一般采用提高温度(500 ℃),是为了加快反应速率,且500 ℃时催化剂活性最大,故C项不符合题意;合成氨采用循环操作,并没有涉及化学平衡的移动,故D项也不符合题意。
答案:B
2.“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用。下列化学反应,不符合绿色化学概念的是( )
A.消除硫酸厂尾气排放:SO2+2NH3+H2O====(NH4)2SO3
B.消除制硝酸工业尾气中氮氧化物污染NO2+NO+2NaOH====2NaNO2+H2O
C.制CuSO4:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O
D.制CuSO4:2Cu+O2 2CuO CuO+H2SO4(稀)====CuSO4+H2O 2CuO CuO+H2SO4(稀)====CuSO4+H2O
解析:A、B、D的反应产物对环境无污染,符合绿色化学概念的要求。而C项中Cu与浓H2SO4反应的产物之一SO2是主要的大气污染物之一,对环境有副作用,不符合绿色化学的概念。
答案:C
3.合成氨所用的H2可由煤与水反应制得,其中有一步反应为CO(g)+H2O(g) 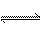 CO2(g)+H2(g);ΔH<0。欲提高CO转化率,可采用的方法有:①降低温度 ②增加压强 ③使用催化剂 ④增大CO的浓度 ⑤增大水蒸气的浓度 CO2(g)+H2(g);ΔH<0。欲提高CO转化率,可采用的方法有:①降低温度 ②增加压强 ③使用催化剂 ④增大CO的浓度 ⑤增大水蒸气的浓度
其中正确的组合是( )
A.①②③④⑤ B.①⑤ C.①④⑤ D.⑤
解析:选择化工生产的适宜条件,就是要根据化工生产的反应特点,选择既能提高化学反应速率,又能提高反应物平衡转化率的合适的外部条件,提高单位时间内的产量。当温与化学反应速率和化学平衡产生矛盾时,一般采用催化剂催化活性最好时的温度。另外在实际化工生产中还要考虑设备要求、综合经济效益、环境保护等一系列问题,这也是综合题目设计的一个热点。该反应是一个气体总体积不变的放热反应,欲提高CO的转化率,可设法使化学平衡向正反应方向移动,显然降低温度可以满足这一要求;增大水蒸气的浓度,平衡向正反应方向移动,CO的转化率也可以增大;若增大CO的浓度,平衡虽然向右移动,但CO的总量增大,其转化率反而减小;增大压强和使用催化剂的操作只能加快反应速率,缩短达到平衡的时间,而与平衡时CO的转化率无关。
答案:B
4.工业上用氨和二氧化碳反应合成尿素:CO2+2NH3====CO(NH2)2+H2O。已知下列物质在一定条件下均能与水反应产生H2和CO2。H2是合成氨的原料,CO2供合成尿素用。若从充分利用原料的角度考虑,选用_________________(填序号)作原料较好( )
|

