|
习题精练
1.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
A.C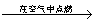 在空气中点燃CO 在空气中点燃CO CO2 CO2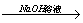 Na2CO3 Na2CO3
B.Cu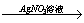 Cu(NO3)2溶液 Cu(NO3)2溶液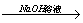 Cu(OH)2 Cu(OH)2
C.Fe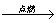 Fe2O3 Fe2O3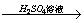 Fe2(SO4)3溶液 Fe2(SO4)3溶液
D.CaO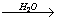 Ca(OH)2溶液 Ca(OH)2溶液 NaOH溶液 NaOH溶液
解析:A中,C在空气中点燃,生成的产物为CO、CO2,虽然CO中混有CO2,但最终并不影响CO2的制取,但气体中混有的N2是无法去除的,并且反应不到位,成本太高,所以不合理。B中,虽然原理上可行,但硝酸银的成本太高,经济上不可行。C中,铁在空气中点燃,通常只能得到四氧化三铁,而得不到三氧化二铁,原理上不可行。D中,利用生石灰与水反应生成的熟石灰与碳酸钠反应制烧碱,是实验室获得少量的烧碱的方法,可行。
答案:D
2.下列操作切实可行的是( )
A.分别通Cl2、SO2于装有品红溶液的两支试管中,就可区别Cl2和SO2
B.分别向装有甲苯和溴苯的两支试管中加水以区别甲苯和溴苯
C.向试管内的溶液中加入NaOH溶液,在试管中用红色石蕊试纸检验溶液中有无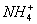
D.某溶液中通入Cl2后,滴入KSCN溶液以检验原溶液中有Fe2+
解析:A中,Cl2通入品红溶液中,首先与溶液中的水反应生成次氯酸,从而使品红溶液的红色褪去。SO2与品红化合生成不稳定的无色化合物,也使品红褪色。所以用品红无法区别Cl2、SO2。B中,甲苯的密度比水小,浮在水面上;溴苯的密度比水大,沉在水底下,只要加入的水和有机物的体积不同,我们便很容易弄清水在上层还是下层。从而达到区分二者的目的。C中,此操作有两点问题,其一是红色石蕊试纸插入试管中,而不是放在试管口;其二是红色石蕊试纸没有用水湿润。因而要么有氨气产生,而试纸未变蓝;要么没有氨气产生,但试纸因接触试管内壁,与NaOH发生反应而变蓝。这两方面操作都不能有力地证明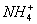 的存在。D中,先通Cl2,后滴入KSCN,虽然溶液变红,但不能肯定溶液中的Fe3+是原来就有的,还是原有的Fe2+被氧化生成的,因而就不能确定溶液中Fe2+的存在。 的存在。D中,先通Cl2,后滴入KSCN,虽然溶液变红,但不能肯定溶液中的Fe3+是原来就有的,还是原有的Fe2+被氧化生成的,因而就不能确定溶液中Fe2+的存在。
答案:B
3.要求设计实验证明某种盐的水解是吸热的,下列回答正确的是( )
A.将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.在盐酸中加入相同浓度的氨水,若混合液温度下降,说明盐类水解是吸热的
C.在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
D.在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
解析:A中,既包含硝酸铵的溶解过程,也包含硝酸铵的水解过程,最后混合液的温度降低,不能说明哪个过程吸热,哪个过程放热。B中,盐酸与氨水发生的是中和反应,不可能吸热。C中,既包含醋酸钠的溶解过程,又包含相同离子对水解的抑制过程,主要为溶解过程。D中, |

