|
2011高考化学备考精析精练
一、选择题(本题包括9个小题,每小题有一个或两个选项符合题意,共45分)
1.在KHSO4的极稀溶液和熔融状态下都存在的离子是( )
A.K+ B.H+ C.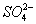 D. D.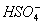
解析:KHSO4在溶液中与在熔化状态下的电离方式不同,在溶液中,KHSO4====K++H++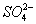 ,在熔化状态下,KHSO4====K++ ,在熔化状态下,KHSO4====K++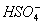 。 。
答案:A
2.将0.1 mol·L-1氨水溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大
C.氨水电离平衡向左移动 D.溶液的pH增大
解析:氨水是弱碱,氨水稀释时,c(OH-)减少,但c(H+)增大,pH减小,平衡左移。
答案:C
3.在氢硫酸溶液中,通入或加入少量下列物质:①O2 ②Cl2 ③SO2 ④CuSO4,能使溶液中的c(H+)增大的是( )
A.①③ B.②④ C.②③④ D.只有①
解析:H2S是弱电解质,在溶液中存在如下平衡:H2S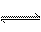 HS-+H+,HS- HS-+H+,HS- H++S2-,若要使溶液中c(H+)增大,上述平衡应向右移动。当加入少量CuSO4时,Cu2+会与S2-结合生成难溶于酸的沉淀,使c(S2-)减少,使上述平衡向右移动,导致溶液中c(H+)增大。若通入O2、SO2、Cl2气体,它们都能与H2S反应,O2与H2S反应使c(H+)减小,后者若通入SO2少量则c(H+)减小,过量,则能生成亚硫酸,使c(H+)增大,但题中已说明是通入“少量”,故不应考虑SO2过量。Cl2与H2S反应生成HCl,HCl是强电解质,应使c(H+)增大。 H++S2-,若要使溶液中c(H+)增大,上述平衡应向右移动。当加入少量CuSO4时,Cu2+会与S2-结合生成难溶于酸的沉淀,使c(S2-)减少,使上述平衡向右移动,导致溶液中c(H+)增大。若通入O2、SO2、Cl2气体,它们都能与H2S反应,O2与H2S反应使c(H+)减小,后者若通入SO2少量则c(H+)减小,过量,则能生成亚硫酸,使c(H+)增大,但题中已说明是通入“少量”,故不应考虑SO2过量。Cl2与H2S反应生成HCl,HCl是强电解质,应使c(H+)增大。
答案:B
4.下列溶液一定呈碱性的是( )
A.溶液中c(OH-)>c(H+) B.溶液中含有OH-
C.滴加甲基橙溶液显黄色 D.pH>7的溶液
解析:溶液呈碱性的实质是c(OH-)>c(H+),A正确。任何水溶液都含有OH-,B不正确。常温下,甲基橙的变色范围为3.1—4.4,能使甲基橙变黄色的溶液不一定为碱性,C不正确。pH>7时有可能c(OH-)=c(H+),呈中性,D不正确。
答案:A
5.依据下列实验,不能证明一元酸HR是弱酸的是( )
A.室温下NaR溶液的pH大于7 B.加热NaR溶液时,溶液的pH
|

