一、无色
内乡高中58届高三化学平衡专项训练
1.下有关反应限度的叙述正确的是 ( )
A.大多数化学反应在一定条件下都有一定的限度
B.依据焓判据:NH4HCO3受热分解可自发进行
C.使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
D.FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深
2.CO2和H2的混合气体加热到1023K时,可建立下列平衡:CO2+H2 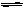 CO+H2O(g), 在该温度下,平衡时有90%的氢气变成水蒸气(K=1),则原混合气体中CO2和H2的分子数之比是 ( )
CO+H2O(g), 在该温度下,平衡时有90%的氢气变成水蒸气(K=1),则原混合气体中CO2和H2的分子数之比是 ( )
A.1:1 B.1:5 C.1:10 D.9:1
3. 工业上常用乙苯作原料生产苯乙烯,相关反应可表示如下(一般控制560℃时):
 CH2CH3(g)
CH2CH3(g)
 CH=CH2(g)+H2(g) ⊿H>0
CH=CH2(g)+H2(g) ⊿H>0
针对上述反应,在其它条件不变时,下列说法正确的是( )
A.加入适当催化剂,可以提高乙苯的转化率
B.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
C.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
D.在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量在不断增大
4. 在容积可变的容器中发生化学反应mA(g)+nB(g)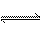 pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如左表所示:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如左表所示: 学科网根据表格数据,下列判断正确的是( )
学科网根据表格数据,下列判断正确的是( )
|
压强/Pa |
2×105 |
5×105 |
1×106 |
|
c(A)/(mol·L-1) |
0.08 |
0.20 |
0.44 |
 A.当压强从2×105Pa增加到5×105Pa时,平衡向左移动
A.当压强从2×105Pa增加到5×105Pa时,平衡向左移动 学科网
学科网
B.化学计量数:m+n=p 学科网
学科网
C.当压强从5×105Pa增加到1×106Pa,平衡不移动 学科网
学科网
D.压强增至1×106Pa时,B、C仍为气态 学科网
学科网
5.对于平衡体系mA (g) + nB (g) pC (g) + qD (g);△H=—QkJ/mol(Q>0)。判断正确的是( )
pC (g) + qD (g);△H=—QkJ/mol(Q>0)。判断正确的是( )
A.若温度不变,将容器体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
B.若平衡时,A、B转化率相等,说明反应开始时,A、B的物质的量之比为m︰n
C.若平衡体系共有a mol气体,再向其中加入b molB,当重新达到平衡时气体总的物质的量等于(a+b)mol,则m+n>p+q
D.温度不变时,若压强增大至原来的2倍,达到新的平衡时总体积一定比原来的1/2小
本资料来源于《七彩教育网》http://www.7caiedu.cn
最常见的要求书写离子方程式的化学方程式集锦
(这些反应方程式是从上千套近10年全国各地高考试题和模拟试题中提炼出来的。在这66个方程式中,还可进一步归类,如1-5为碱溶液中通入酸性气体;6-12为盐溶液中通入酸性气体;16-20为亚铁盐溶液与卤素的反应;23-25为盐溶液与单质的反应;27-31为硝酸参与的氧化还原反应;34-51均为盐溶液与碱液的反应;52-60均为盐溶液与酸液的反应等。练好这些化学方程式和离子方程式的书写,可以说再解此类题所向披靡。)
1、向氢氧化钠溶液中通入少量CO2 : 2NaOH + CO2 ==== Na2CO3+ H2O
2、在标准状况下2.24LCO2通入1mol/L 100mLNaOH溶液中:CO2+NaOH , , , , NaHCO3
3、烧碱溶液中通入过量二氧化硫: NaOH +SO2==NaHSO3
4、在澄清石灰水中通入过量二氧化碳:Ca(OH)2+ 2CO2══Ca(HCO3)2
5、氨水中通入少量二氧化碳: 2NH3•H2O+CO2== (NH4)2 CO3+ H2O
6、用碳酸钠溶液吸收少量二氧化硫 : Na2CO3+ SO2 Na2SO3+ CO2↑
7、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2 +H2O══2 NaHCO3
8、在醋酸铅[Pb(Ac)2]溶液中通入H2S气体:Pb(Ac)2+H2S=PbS↓+2HAc
9、苯酚钠溶液中通入少量二氧化碳: CO2+H2O+C6H5ONa→C6H5OH+ NaHCO3
10、氯化铁溶液中通入碘化氢气体: 2FeCl3+2 HI 2Fe Cl2+ I2+2 H Cl
11、硫酸铁的酸性溶液中通入足量硫化氢:Fe2(SO4)3+ H2S==2 FeSO4+ S↓+ H2SO4
12、少量SO2气体通入NaClO溶液中:2NaClO +2SO2+ 2H2O══Na2 SO4+ 2HCl+H2SO4
13、氯气通入水中:Cl2+H2O HCl+HClO
14、氟气通入水中:2F2+2H2O 4HF+O2↑
15、氯气通入冷的氢氧化 物质

