|
课题二、金属的化学性质
考试要求
知道常见金属与氧气及常见酸的反应
初步认识置换反应,并能解析常见的化学反应
能用金属活动顺序对有关置换反应作简单的判断,并能解析常见的化学反应
考点一、金属的化学性质
1、大多数金属可与氧气的反应
 2Mg +O2 2Mg +O2 2MgO 2Mg +O2 2MgO 注:MgO:白色固体 2MgO 2Mg +O2 2MgO 注:MgO:白色固体
 4Al +3O2 4Al +3O2  2Al2O3 4Al +3O2 2Al2O3 注:Al2O3:白色固体 2Al2O3 4Al +3O2 2Al2O3 注:Al2O3:白色固体
3Fe +2 O2  Fe3O4 2Cu + O2 Fe3O4 2Cu + O2  2CuO 注:CuO:黑色固体 2CuO 注:CuO:黑色固体
注意:①、虽然铝在常温下能与氧气反应,但是在铝表面生成了一层致密的氧化铝薄膜,从而阻止了反应的进行,所以铝在常温下不会锈蚀。
②、“真金不怕火炼”说明金即使在高温时也不能与氧气反应,金的化学性质极不活泼。
2、金属 + 酸 → 盐 + H2↑ 置换反应(条件:活动性:金属>H )
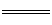 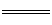 H2SO4 + Mg MgSO4 + H2↑ 2HCl + Mg MgCl2+ H2↑ H2SO4 + Mg MgSO4 + H2↑ 2HCl + Mg MgCl2+ H2↑
现象:反应剧烈,有大量气泡产生,液体仍为无色
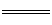  3H2SO4 + 2Al Al2(SO4)3 + 3H2↑ 6HCl + 2Al 2AlCl3+ 3H2↑ 3H2SO4 + 2Al Al2(SO4)3 + 3H2↑ 6HCl + 2Al 2AlCl3+ 3H2↑
现象:反应剧烈,有大量气泡产生,液体仍为无色
  H2SO4 +Zn ZnSO4 + H2↑ 2HCl +Zn ZnCl2 + H2↑ H2SO4 +Zn ZnSO4 + H2↑ 2HCl +Zn ZnCl2 + H2↑
现象:反应比较剧烈,有大量气泡产生,液体仍为无色
  H2SO4 + Fe FeSO4 + H2↑ 2HCl + Fe FeCl2+ H2↑ H2SO4 + Fe FeSO4 + H2↑ 2HCl + Fe FeCl2+ H2↑
现象:反应比较缓慢,有气泡产生,液体由无色变为浅绿色 当一定质量的金属与足量的 |

