|
选修四 第四章 第三节电解池
一、教学目标:
1.理解电解原理,初步掌握一般电解反应产物的判断方法
2.了解氯碱工业,电镀,冶金的原理
3.掌握电解电极方程式的书写。
二、教学重点:
电解原理及应用
三、教学过程:
我们知道化学能可以转变为热能,即反应热。化学能也能转变为电能,用原电池装置。今天这节课我们就来学习电能如何转化为化学能。
第三节电解池
一、电解原理
讲:首先我们来比较金属导电和电解质导电的区别。
|
|
金属 |
电解质 |
|
导电粒子 |
|
|
|
导电状态 |
|
|
|
温度影响 |
|
|
|
导电实质 |
电子定向移动 |
|
过渡:电解质导电的实质是什么呢?一起看实验。
实验:现象—一极有气泡,检验为氯气;另一极有红色的物质析出,分析为铜。
讲:要分析此现象我们得研究此装置,首先看电极。
1.电极
阳极—与电源正极相连
阴极—与电源负极相连
隋性电极—只导电,不参与氧化还原反应(C/Pt/Au)
活性电极—既导电又参与氧化还原反应(Cu/Ag)
问:通电前和通电时分别发生了怎样的过程?
通电前:CuCl2=Cu2++2Cl- H2O 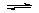 H++OH- H++OH-
通电中:阳离子(Cu2+,H+)向阴极移动被还原;
阴离子(Cl-,OH-)向阳极移动被氧化
讲:即在电极上分别发生了氧化还原反应,称电极反应。
2.电极反应( 阳氧阴还 )
阳极:2Cl- -2e-=Cl2 (氧化)
阴极:Cu2++2e-=Cu(还原)
总电极方程式:___________________
放电:阴离子失去电子或阳离子得到电子的过程叫放电。
3.电解:电流(外加直流电)通过电解质溶液而在阴阳两极引起氧化还原反应(被动的不是自发的)的过程叫电解。
讲:所以电解质导电的实质便是——电解
电解池:借助电流引起氧化还原反应的装置,即把电能转化为化学能的装置叫电解池或电解槽。
问:构成电解池的条件是什么?
电源、电极、电解质构成闭和回路。
思考: 电解CuCl2水溶液为何阳极是Cl-放电而不是OH-放电,阴极放电的是Cu2+而不是H+ ? |

