|
第一节 弱电解质的电离
一、选择题(包括8小题。1~6小题只有一个选项符合题意,7~8小题有两个选项符合题意。)
1.下列关于电解质的说法正确的是( )
A.NaHCO3溶于水,其电离方程式为:NaHCO3=Na++HCO3-, HCO3-=H++CO32-
B.SO2的水溶液能导电,所以SO3为电解质
C.浓度均为1 mol·-1L的NaCl和MgSO4溶液,导电能力相同
D.NaCl晶体不导电是由于NaCl晶体中不存在离子
2.(2009年肇庆质检)在25 ℃时的醋酸溶液,若采用下列不同的措施:①加入NaOH固体;②加入CaCO3固体;③加等体积的水稀释;④加热醋酸溶液使温度上升10 ℃;⑤加入醋酸钠固体;⑥加入盐酸。其中能促进醋酸电离的有( )
A.①③④
B.①②③④
C.①③④⑤
D.①②③④⑤
3.(2009年汕头质检)同一温度下,强电解质溶液a,弱电解质溶液b,金属导体c三者的导电能力相同,若升高温度后,它们的导电能力强弱的顺序是( )
A.a=b=c
B.b>a>c
C.c>a>b
D.b>c>a
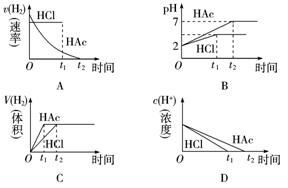
4.向体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.28 g Fe,则下图中的曲线符合反应事实的是( )
5.在二氧化碳的水溶液中存在着如下平衡:
CO2(g)=CO2(aq)
CO2(aq)+H2O=H2CO3(aq)
H2CO3(aq)=H+(aq)+HCO3-(aq)
HCO3-(aq)=H+(aq)+CO32-(aq)
下列有关说法正确的是( )
A.水中溶解的二氧化碳的浓度,夏天比冬天高
B.如果海水略呈碱性,海水中二氧化碳的浓度比纯水高
C.气压升高,水中c(HCO3-)增大
D.常温下,二氧化碳的水溶液中,由水电离的c(H+)与c(OH-)的乘积等于1×10-14
6.甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )
①甲中由水电离出来的H+的物质的量浓度是乙的1/10
②物质的量浓度c(甲)=10c(乙)
③中和等物质的量的NaOH溶液需甲、乙两种酸的体积,10V(甲)>V(乙)
④甲中的c(OH-)为乙中的c(OH-)的10倍
A.①②④正确
B.①③正确
C.②④正确
D.只有①正确
7.对氨水溶液中存在的电离平衡NH3·H2O=NH4++OH-,下列叙述正确的是( )
A.加水后,溶液中n(OH-)增大
B.加入少量浓盐酸,溶液中c(OH-)增大
C.加入少量浓NaOH溶液,电离平衡向正反应方向移动
D.加入少量NH4Cl固体,溶液中c(NH4+)增大
8.下列实验事实不能证明醋酸是弱酸的是( )
A.常温下,醋酸溶液能与石灰石反应生成CO2
B.常温下,测得0.1 mol·-1L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和 |

