|
2011高考化学解题方法系列专题6·守恒法
“守恒法”是中学化学经常采用的技巧性解题方法之一。
一般情况下,能用“守恒法”解答的题目也能用其它方法解决,但较费时且易出错。而 “守恒法”则是利用物质变化过程中某一特定量固定不变来解决问题,其特点是不纠缠于细枝末节,只关注始态和终态,寻找变化前后特有的守恒因素,快速建立等式关系,巧妙作答,能提高解题速率和准确率。
“守恒法”在不同版本的教辅材料中,有多种表述形式,如物料守恒、质量守恒、元素守恒、原子守恒、离子守恒、电荷守恒、电子守恒、物质的量守恒、体积守恒…等等。其实所谓的“守恒”因素不外乎三种情况:一是物料守恒,二是电性电量守恒。
一、物料守恒
所谓“物料”,就是物质。从物质的形态而言,有宏观意义上的物质,又有微观意义上的粒子。当谈到“物料”守恒时,对宏观物质而言,主要是质量守恒;对微观粒子而言,则主要是与物质的量挂钩的元素守恒 。 。
(一)质量守恒
在此探讨的质量守恒,已不再是狭义的质量守恒定律,它涵盖了物理和化学两种变化中的有关守恒关系。
1.固态混合物
由固体物质组成的混合物,往往在化学变化前后存在某一方面的守恒因素,利用这些因素可省时省力。
例1:取一定量的KClO3和MnO2的混合物共热制取O2,反应开始时MnO2在混合物中的质量分数为20%,当反应进行到MnO2在混合物中的质量分数为25%时,求KClO3的分解百分率。
解析:MnO2在反应中作催化剂,反应前后质量守恒。设原混合物的质量为m1g,反应结束后混合物的质量为m2g,则MnO2反应前后的质量分别为:0.2m1g和0.25m2g。由MnO2的质量守恒可得:0.2m1g=0.25m2g,m2=0.8m1。由反应前后质量守恒可知,放出O2的质量应等于反应前后的固体质量之差,即:m1g-m2g=m1g-0.8m1g=0.2m1g。即可求得KClO3的分解百分率为: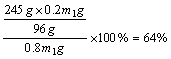 。 。
2.溶液
对溶液而言,可以从其组成上,即浓度(质量分数)、溶剂和溶质三方面去寻找内含的某些守恒因素,用于解决有关溶液计算的问题。
(1)浓度守恒
例2:某盐的饱和溶液的质量分数为26.8%,取一定量的此饱和溶液,加入wg该无水盐,在温度不变的情况下,析出mg含有一定量结晶水的该盐晶体,则从饱和溶液中析出溶质的质量为
A.26.8%w B.m-w
C.(m+w)×26.8% D.(m-w)×26.8%
解析:由于温度不变,析晶后,剩余溶液、减少的溶液(m-w)及原溶液浓度(质量分数)守恒,故有(m-w)×26.8%,答案应选D。 |

