|
习题精练
1.下列有关滴定操作的顺序正确的是( )
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④ C.⑤②③①④ D.②①③⑤④
解析:本题主要考查学生对中和滴定操作的掌握程度,要依据中和滴定操作的步骤顺序进行分析判断。
答案:B
2.现用0.10 mol·L-1的盐酸滴定10 mL 0.05 mol·L-1的NaOH溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是( )
A.10 mL B.5 mL C.大于5 mL D.小于5 mL
解析:0.1 mol·L-1的盐酸滴定10 mL 0.05 mol·L-1的NaOH溶液正好需5 mL 盐酸,现盐酸被稀释,其浓度小于0.10 mol·L-1,中和NaOH所需体积大于5 mL。
答案:C
3.某稀NaOH溶液的浓度大约在0.07—0.08 mol·L-1之间,实验室现有①0.1 mol·L-1②1.0 mol·L-1 ③5.0 mol·L-1的三种标准盐酸,若要通过中和滴定法确定氢氧化钠的准确浓度,则应选用的标准盐酸是( )
A.① B.② C.③ D.①②③均可
解析:强酸与强碱中和滴定时,酸与碱溶液中的c(H+)和c(OH-)的浓度越接近,测出的待测液浓度越准确。若标准液的浓度比待测液浓度大得多,那么同样体积的误差所造成的待测液浓度误差就大;若标准液的浓度比待测液浓度小得多,往往容易造成滴定管中标准液的体积读数已接近最大值,但尚未使指示剂变色,这时就需要第二次灌装标准液继续滴定,由于多次读取体积,易造成较大的体积误差,使测出的待测液浓度误差也变大,故该题应选A。
答案:A
4.实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色时,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2—3次
解析:A中标准液体积偏大,c(NaOH)偏高;B中标准液体积偏大,c(NaOH)偏高;C中溶液颜色由黄色变橙色,立即停止滴定,有可能是局部过量造成,摇动锥形瓶,仍显黄色,这样V(HCl)偏低,c(NaOH)偏低;D中锥形瓶用NaOH润洗后,消耗V(HCl)偏大,c(NaOH)偏高。
答案:C
5.用已知浓度的盐酸来测定某Na2CO3溶液的浓度时,若配制Na2CO3溶液时所用Na2CO3中分别含有:①NaOH ②NaCl ③NaHCO3④K2CO3杂质,所测结果偏低的是( )
A.仅① B.仅② C.②③ D.②③④
解析:1 mol HCl消耗Na2CO3的质量为53 g。若所测结果偏低,则1 mol HCl消耗杂质的质量应大于53 g,由此可判断使测定结果偏低的有②③④。
答案:D
6.有①②③三瓶体积相等、浓度都是1 mol·L-1的HCl溶液,将①加热蒸发至体积减少一半,在②中加入少量CH3COONa固体(加入后溶液仍呈强酸性),③不作改变,然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗的NaOH溶液的体积是( )
A.①=③>② B.③>②>①
C.③=②>① D.①=②=③
解析:这是一道化学学科内有关化学实验、酸碱中和滴定、电离平衡移动、盐类水解等的综合题。“陷阱”设在①中,蒸发时溶液中的水分子和HCl分子将同时挥发出来,溶液中盐酸浓度要降低;对于②中加入CH3COONa固体,CH3COO-+H+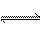 CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中和,所以消耗NaOH的体积不会变化。 CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中和,所以消耗NaOH的体积不会变化。
答案:C
|

