|
2011年高考化学一轮精品讲练析
第15讲 难溶电解质的溶解平衡

1. 能描述沉淀溶解平衡,知道沉淀转化的本质
2. 了解难溶电解质的溶解平衡
基础过关 | | 
溶度积原理及其应用
1.了解沉淀溶解平衡的本质
⑴难溶电解质的溶解平衡
在一定重要条件下,当沉淀与溶解的速度相等时,便达到固体难溶电解质与溶液中离子间的平衡状态。例如:
BaSO4(s) 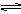 Ba2+(aq) + SO42-(aq) Ba2+(aq) + SO42-(aq)
⑵溶度积:在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之乘积为一常数,称为溶度积常数,简称溶度积。用符号Ksp表示。
对于AmBn型电解质来说,溶度积的公式是:Ksp=[An+]m[Bm+]n
① 溶度积与溶解度的关系
溶度积和溶解度都可以表示物质的溶解能力,溶度积的大小与溶解度有关,它反映了物质的溶解能力。
② 溶度积规则,可以判断溶液中沉淀的生成和溶解。
③ 离子积Qc与溶度积Ksp的区别与联系
某难溶电解质的溶液中任一情况下有关离子浓度的乘积Qc
当Qc<Ksp时,为不饱和溶液;
当Qc=Ksp时,为饱和溶液;
当Qc>Ksp时,为过饱和溶液。
2. 了解沉淀转化的原理
⑴沉淀的生成:可通过调节溶液PH或加入某些沉淀剂。
⑵沉淀的溶解:
①生成弱电解质。如生成弱酸、弱碱、水或微溶气体使沉淀溶解。难溶物的Ksp越大、生成的弱电解质越弱,沉淀越易溶解。如CuS、HgS、As2S3等Ksp太小即使加入浓盐酸也不能有效降低S2-的浓度使其溶解。
②发生氧化还原反应,即利用发生氧化还原反应降低电解质离子浓度的方法使沉淀溶解。
③生成难电离的配离子,指利用络合反应降低电解质离子浓度的方法使沉淀溶解。
⑶沉淀的转化:把一种难溶电解质转化为另一种难溶电解质的过程叫沉淀的转化。
在含有沉淀的溶液中加入另一种沉淀剂,使其与溶液中某一离子结合成更难溶的物质,引起一种沉淀转变成另一种沉淀。例如:
CaSO4(s)+Na2CO3 = CaCO3(s)+Na2SO4
在氯化银饱和溶液中,尚有氯化银固体存在,当分别向溶液中加入下列物质时,将有何种变化?
在氯化银饱和溶液中,尚有氯化银固体存在,当分别向溶液中加入下列物质时,将有何种变化?
|
加入物质 |
平衡移动方向 |
AgCl溶解度 |
溶液中C(Ag+) |
溶液中C(Cl-) |
发生变化的原因 |
|
0.1mol·L-1HCl |
|
|
|
|
|
|
0.1mol·L-1AgNO3 |
|
|
|
|
|
|
KNO3(s) |
|
|
|
|
|
|
0.1mol·L-1NH3·H2O |
|
|
|
|
|
|
H2O |
|
|
|
|
| |

