《现代教育报·新课程周刊》原创精品样稿
巧用“等化合价法则”求解元素的质量分数
河北 刘树学
根据“在化合物里,正负化合价的代数和为零”,我们可推出“在化合物里,正化合价代数和与负化合价代数和的绝对值相等”这一等化合价法则。巧妙运用此法则,会给解题带来意想不到的方便。
例1 某金属R的氧化物与还原剂反应后可得金属R,金属R的氧化物质量减少了30%,R的相对原子质量为56,则该金属氧化物的化学式为________
解析:金属R的氧化物被还原剂还原为R后,质量减少了30%,说明在该金属氧化物中,氧元素的质量分数为30%。
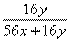 若根据化学式来计算,可设该金属氧化物的化学式为RxOy 若根据化学式来计算,可设该金属氧化物的化学式为RxOy
O% = × 100%
 又因为O% = 30% 所以= 30% 得x/y=2/3 又因为O% = 30% 所以= 30% 得x/y=2/3
因此该金属R的氧化物的化学式为R2O3
该法运算量较大,若运用“等化合价法则”来解则更方便。
设参加反应的氧化物的质量为100,则氧元素质量为30,
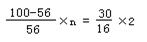 金属元素R的质量为100—30 金属元素R的质量为100—30
设该氧化物中金属元素R的化合价为+n,则
则该氧化物的化学式为R2O3
巩固练习:金属元素R的磷酸盐的化学式为Rx(PO4)y,其中PO4(磷酸根)为-3价,元素R的质量分数为42%,其相对原子质量为23,则该化合物中元素R的化合价为 价。
答案:+1
此法不但对化合物适用,对由化合物所组成的混合物也同样适用。
例2 某混合物中含MgSO4和Fe2(SO4)3,经实验测知其中硫元素的质量分数为25%,则镁元素的质量分数为 .
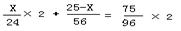 解析:不论MgSO4和Fe2(SO4)3以何种比例混合,S和O原子的个数比恒为1:4,质量比恒为(32 :16×4 = 1 :2)。据S%=25%,可知O%=50%,则混合物中SO4%=20%+40%=75%,也就是该混合物中Mg%+Fe%=25%,设混合物总质量为100,则SO4%的质量为75,设镁的质量为X,则铁的质量为25-X ,根据等化合价法则, X=7.5 解析:不论MgSO4和Fe2(SO4)3以何种比例混合,S和O原子的个数比恒为1:4,质量比恒为(32 :16×4 = 1 :2)。据S%=25%,可知O%=50%,则混合物中SO4%=20%+40%=75%,也就是该混合物中Mg%+Fe%=25%,设混合物总质量为100,则SO4%的质量为75,设镁的质量为X,则铁的质量为25-X ,根据等化合价法则, X=7.5
所以Mg%=7.5%
巩固练习:经分析知,某含CaCl2和CaO的混合物中钙元素的质量分数为47.9%,求混合物中氯元素的质量分数。
答案:42.5%
|

