|
燃烧热 能源
课时安排:2课时。
第一课时 燃烧热
第二课时 中和热
教学方法:启发、讨论、归纳法。
教学过程:
第一课时
[引言]复习热化学方程式的意义;书写热化学方程式的注意事项,引入新课。
[板书]一、燃烧热
1. 定义:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
[学生讨论、归纳概念要点]
(1) 在101kPa时,生成稳定的氧化物。如C完全燃烧应生成C02(g),而生成CO(g)属于不完全燃烧。又如H2燃烧生成液态H20,而不是气态水蒸气。
(2) 燃烧热通常是由实验测得的。
(3) 可燃物以1mol作为标准进行测量。
(4) 计算燃烧热时,热化学方程式常以分数表示。
例:H2(g)+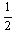 O2(g)=H20(1); O2(g)=H20(1);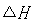 =-285.8kJ/mol =-285.8kJ/mol
[板书]2.研究物质燃烧热的意义。
了解化学反应完成时产生热量的多少,以便更好地控制反应条件,充分利用能源。
[板书]3.有关燃烧热的计算
[投影]例1 10g硫磺在O2中完全燃烧生成气态S02,放出的热量能使500gH20温度由18℃升至62.4℃,则硫磺的燃烧热为_____,热化学方程式为______
[分析讨论]
10g硫磺燃烧共放出热量为:Q=m·c(t2-t1)=500g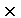 4.18 4.18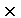 10 10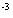 kJ·g kJ·g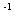 ·C ·C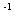 (62.4-18)C=92.8kJ,则1mol(32g)硫磺燃烧放热为 (62.4-18)C=92.8kJ,则1mol(32g)硫磺燃烧放热为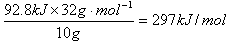 ,硫磺的燃烧热为297kJ·mol,热化学方程式为:S(s)+02(g)=S02(g); ,硫磺的燃烧热为297kJ·mol,热化学方程式为:S(s)+02(g)=S02(g);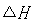 =-297kJ/mol =-297kJ/mol [投影]例2 0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出649.5kJ热量,其热化学方程式为:___________。又已知H20(1)=H20(g);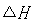 =+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出热量是多少kJ? =+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出热量是多少kJ?
|

