|
第2章 化学反应的方向、限度与速率
第2节 化学反应的限度
学习目标
1. 掌握化学平衡常数的数字表达式。
2. 理解化学平衡常数的意义,会用化学平衡常数判断反应进行的方向。
3. 掌握有关化学平衡的计算。
4. 掌握浓度、压强、温度对化学平衡的影响规律,会判断化学平衡移动的方向。
知识梳理
1. 化学平衡常数K及表达式
化学平衡常数可定量描述化学反应的限度。
在______一定时,对于确定的反应,K为常数,压强、浓度的改变与平衡常数______(无关,有关)。K值越大,反应进行的越________。
aA + bB c C + d D , Kc =______________________
(1)对于有纯固体或纯液体参加的反应,如:CaCO3(s) CaO(s)+CO2(g), Kc =_______
C(B)表示____________ C0(B)表示____________ [B] 表示____________
(2)若A、B、C、D均为气体,Kp =________________
※气体分压定律:
混合气体中某组分气体_____________所表现的压强为该气体的分压强,简称分压。
总压强为混合气体各组分分压________。
混合气体中,分压之比与气体物质的量有何关系?当体积一定时,与浓度又有何关系?
__________________________________________________________________________
浓度平衡常数(Kc):由各物质_________算得的平衡常数。
(3)化学平衡常数
压强平衡常数(Kp):由各物质_________算得的平衡常数。
(4)可逆反应的化学平衡常数表达式与方程式的书写有关。
3H2(g) + N2(g) 2NH3(g) K1= __________
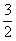 H2(g) + H2(g) +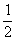 N2(g) NH3(g) K2=__________ N2(g) NH3(g) K2=__________
2NH3(g) 3H2(g) + N2(g) K3=___________
K1 ,K2,K3之间的关系_____________________
2. 用化学平衡常数判断反应进行的方向
对于化学反应 aA + bB c C + d D,浓度商Qc =_______________
当 Qc =Kc时,反应________________;
Qc>Kc时,反应________________;
Qc<Kc时,反应________________。
3. 化学平衡的计算
(1) 可逆反应达到平衡过程中物质浓度的变化关系
反应物:平衡浓度 = ______________________;
生成物:平衡浓度 = ______________________。
各物质的转化浓度之比等于_________________之比。
(2)平衡转化率
对于化学反应 aA + bB c C + d D 反应物A的转化率α(A)=_________________
① 温度一定,反应物的转化率因反应物的不同而不同。
② 提高A在原料气中的比例,可使B的转化率________,而A的转化率_________。
提高B在原料气中的比例,可使A的转化率________,而B的转化率_________。
(3)平衡时某组分的百分含量 A%=____________________ 4. 反应条件对化学平衡的影响 |

