|
习题精练
1.(2010江苏高考,8)在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是( )
A.硫在空气中燃烧 B.铜片与浓硫酸共热
C.红热的木炭与浓硫酸反应 D.亚硫酸钠与稀硫酸反应
解析:本题主要考查氧化还原反应的本质,要求考生掌握硫及其化合物在转化过程中的价态变化,侧重考查考生的审题能力和理解能力。含硫物质被氧化则硫元素的价态升高,B、C选项硫酸中的硫元素化合价降低,D项中硫元素的价态不变。故选A。
答案:A
2.下面描述二氧化硫的一些化学性质中,二氧化硫作还原剂的是( )
A.溶于水生成不稳定的H2SO3 B.与H2S气体混合出现淡黄色固体
C.通入品红溶液中,品红溶液褪色 D.能使溴水褪色
解析:二氧化硫溶于水生成不稳定的H2SO3,是酸性氧化物的通性,二氧化硫是亚硫酸的酸酐;与H2S气体混合出现淡黄色固体,二氧化硫表现氧化性;二氧化硫使品红溶液褪色,表现漂白性;二氧化硫通入溴水中,可被溴水氧化为硫酸,二氧化硫表现还原性。
答案:D
3.(2010广东中山质检)足量的浓H2SO4与m g铜完全反应,得到的SO2气体的体积为n L(20 ℃、1.01×105 Pa),则被还原的硫酸是( )
A.m/64 mol B.64n/22.4 mol
C.98n/22.4 g D.64n/22.4 g
解析:根据化学方程式Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O计算,被还原的硫酸可用铜的量来表示,其值为m/64 mol,也可用生成的二氧化硫的量来表示,但考虑到产生的气体体积不是在标准状况下测定的,因此不能选C。 CuSO4+SO2↑+2H2O计算,被还原的硫酸可用铜的量来表示,其值为m/64 mol,也可用生成的二氧化硫的量来表示,但考虑到产生的气体体积不是在标准状况下测定的,因此不能选C。
答案:A
4.将浓硫酸慢慢滴入浓盐酸中,产生的现象是( )
A.放出黄绿色气体 B.冒白雾,混合物温度升高
C.液体四溅,冒白烟 D.冒白雾,温度降低
解析:浓盐酸具有强挥发性,产生的HCl在空气中形成白雾。浓盐酸中滴入浓硫酸时,因浓硫酸具有吸水性而使盐酸浓度增加,同时浓硫酸吸水放热,混合物的温度升高。
答案:B
5.下列四种溶液中,一定存在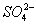 的是( ) 的是( )
A.向甲溶液中加入BaCl2溶液,产生白色沉淀
B.向乙溶液中加入BaCl2溶液,有白色沉淀,再加入盐酸,常常不溶解
C.向丙溶液中加入盐酸使之酸化,再加入BaCl2溶液,有白色沉淀产生
D.向丁溶液中加入硝酸酸化,再加入硝酸钡溶液,有白色沉淀产生
解析:本题为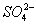 鉴定题,鉴定 鉴定题,鉴定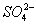 存在要排除干扰离子,例如 存在要排除干扰离子,例如 、 、 、 、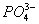 、Ag+等,这样才能准确把握确定 、Ag+等,这样才能准确把握确定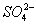 的存在。 的存在。
甲溶液中可能存在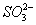 、 、 、 、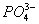 或Ag+;乙溶液中可能存在Ag+;丁溶液中用硝酸酸化,若溶液中存在 或Ag+;乙溶液中可能存在Ag+;丁溶液中用硝酸酸化,若溶液中存在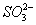 ,会被氧化成 ,会被氧化成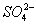 ,故答案为C。 ,故答案为C。
答案:C
6.(2010广东广州联考)将SO2通入BaCl2溶液至饱和,未见沉淀,继续通入另一种气体X仍未沉淀,则X可能是( )
A.CO2 B.NH3
C.Cl2 D.NO2
解析:B:NH3+SO2+H2O====2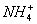 + +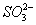 ; ;
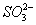 +Ba2+====BaSO3↓; +Ba2+====BaSO3↓;
C:Cl2有氧化性,Cl2+SO2+2H2O====4H++2Cl-+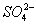 , ,
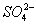 +Ba2+====BaSO4↓; +Ba2+====BaSO4↓;
D:NO2具有氧化性,将SO2氧化为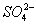 ,而生成BaSO4↓。 ,而生成BaSO4↓。
答案:A
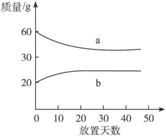
7.(2010上海高考,8)浓硫酸和2 mol·L-1的稀硫酸,在实验室中敞口放置。它们的质量和放置天数的关系如图6-3。分析a、b曲线变化的原因是( )
|

